Ist Seife eine Säure oder Base und wie funktioniert sie?
Was ist Seife?
In der Chemie, Seife ist ein Salz von einem Fettsäure . Seifen werden hauptsächlich verwendet für Waschen , Baden , Und Reinigung . Seifen zur Reinigung werden durch die Behandlung pflanzlicher oder tierischer Öle und Fette mit einem starken Mittel gewonnen alkalisch Lösung. Fette und Öle bestehen aus Triglyceride ; drei Moleküle von Fettsäuren sind an ein einzelnes Molekül gebunden Glycerin . Die alkalische Lösung, die oft genannt wird Lauge (obwohl sich der Begriff „Laugenseife“ fast ausschließlich auf Seifen bezieht, die mit hergestellt wurden Natriumhydroxid ), bewirkt a chemische Reaktion bekannt als Verseifung . Bei dieser Reaktion werden die Triglyceridfette zunächst zu freien Fettsäuren hydrolysiert, die sich dann mit dem Alkali zu Rohseife verbinden, einem Amalgam aus verschiedenen Seifensalzen, überschüssigem Fett oder Alkali und Wasser, und freigesetzt werden Glycerin (Glyzerin). Das Glycerin ist ein nützliches Nebenprodukt, das als Weichmacher im Seifenprodukt verbleiben oder für andere Zwecke isoliert werden kann.
Wie funktioniert Seife?
Seife ist aufgrund ihrer Fähigkeit, als Emulgator zu wirken, ein ausgezeichnetes Reinigungsmittel. Ein Emulgator ist in der Lage, eine Flüssigkeit in einer anderen, nicht mischbaren Flüssigkeit zu dispergieren. Das bedeutet, dass sich Öl (das Schmutz anzieht) zwar nicht auf natürliche Weise mit Wasser vermischt, Seife jedoch Öl/Schmutz so suspendieren kann, dass er entfernt werden kann.
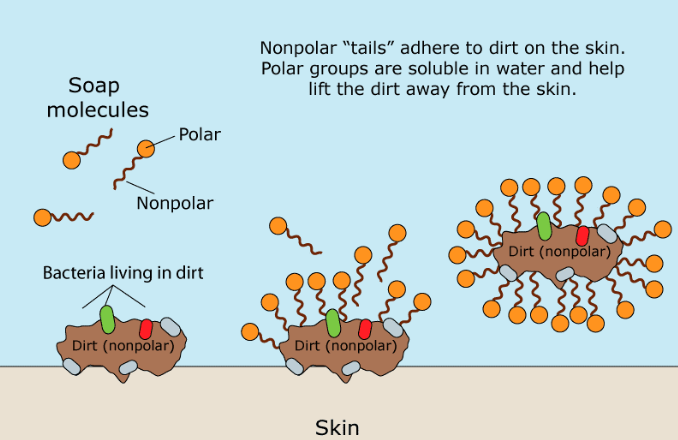
Der organische Teil der Naturseife ist ein negativ geladenes, polares Molekül. Seine hydrophile (wasserliebende) Carboxylatgruppe (-CO2) interagiert mit Wassermolekülen über Ionen-Dipol-Wechselwirkungen und Wasserstoffbrückenbindungen. Der hydrophobe (wasserabweisende) Teil eines Seifenmoleküls, seine lange, unpolare Kohlenwasserstoffkette, interagiert nicht mit Wassermolekülen. Die Kohlenwasserstoffketten werden durch Dispersionskräfte zueinander angezogen und gruppieren sich zu Strukturen, die als Mizellen bezeichnet werden. In diesen Mizellen bilden die Carboxylatgruppen eine negativ geladene Kugeloberfläche, wobei sich die Kohlenwasserstoffketten innerhalb der Kugel befinden. Aufgrund ihrer negativen Ladung stoßen sich Seifenmizellen gegenseitig ab und bleiben im Wasser dispergiert.
Fette und Öle sind unpolar und wasserunlöslich. Wenn Seife und Schmutzöle gemischt werden, spaltet der unpolare Kohlenwasserstoffanteil der Mizellen die unpolaren Ölmoleküle auf. Es bildet sich dann ein anderer Mizellentyp mit unpolaren Schmutzmolekülen im Zentrum. Dadurch werden Fette und Öle sowie der daran haftende „Schmutz“ in der Mizelle festgehalten und können weggespült werden.
Ist Seife eine Säure oder eine Base?
Seife ist weder eine Säure noch eine Base, sondern ein basisches Salz. Es ist eine Kombination aus schwacher Säure und starker Base. Wenn eine Säure und eine Base in einer bestimmten Menge kombiniert werden, entstehen Salz und Wasser. Und wenn das Salz in seiner Kombination eine stärkere Base aufweist, zeigt es basischen Charakter.
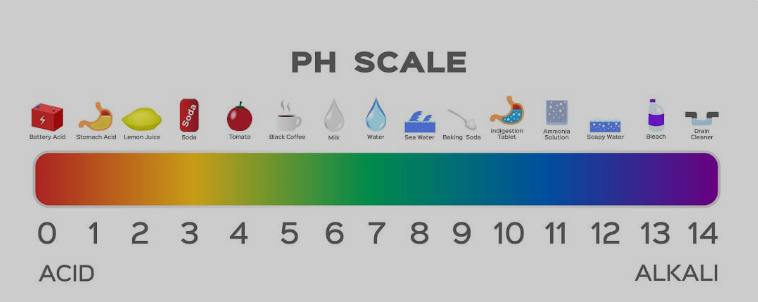
Ist Seife eine starke oder schwache Säure/Base?
Seife hat einen schwach basischen Charakter. Obwohl bei der Herstellung von Seifen starke Basen verwendet werden, neutralisieren die bei der Reaktion verwendeten schwachen Säuren die Wirkung bis zu einem gewissen Grad. Wenn Sie zur Messung einen pH-Streifen verwenden, zeigen die meisten Seifen einen pH-Wert von 9–10 an. Starke Basen liegen auf der pH-Skala zwischen 12 und 14.